الانزيمات Enzymes
تطورت دراسة الانزيمات بسرعة واصبحت لها حدود وابعاد واضحة, واخذت تتصرف
بوصفها علماً مستقلاً يرتبط بروابط قوية مع علوم اخرى مثل الكيمياء والفيزياء وعلم
الاحياء (الاحياء المجهرية, وعلم الحيوان, وعلم النبات). وكذلك العلوم الزراعية
والطبية كالباثولوجيا , والهندسة الكيميائية, وغيرها من العلوم الاخرى الكيميائية
منها والحياتية.
وقد نتج عن تطور بحوث الانزيمات استعمالات كثيرة وتطبيقات متنوعة اذ تم على
سبيل المثال استعمال الانزيمات في:
تشخيص العديد من الامراض كامراض القلب والكبد وغيرها.
معالجة امراض عدة كامراض المعده والامعاء وغيرها.
الصناعات الكيميائية الحربية المتنوعة.
قياس العديد من المركبات سواء داخل الجسم الحي او خارجة.
المساهمة وبصورة مباشرة في بناء علم الهندسة الوراثية الحديث.
ان الاعتراف التام بعلم الانزيمات تاكد عام 1833 عندما لاحظ كل من العالمين
باير وبيرسيز احتواء الراسب الكحولي ( خلاصات الشعير) على مادة عطرية قادرة على
تحويل النشا الى سكر احادي بواسطة الانزيم النشواز (Amylase ) الذي سمي
حينئذ (Diastase)
, واقترح دكلور عام 1898 استعمال الاحرف الثلاثة ase _ ليضاف الى المادة التي تتحول الى منتوج مثل
(سكريز) للمادة سكروز و (المالتيز) عند الاضافة للمادة مالتوز.
وقد اختلف العالمان لابيك وباستور عندما اعتقد الاول ان عملية التخمر تحدث
نتيجة تأثير بعض المواد الكيميائية المحضرة, واجتهد الثاني (باستور) بعدم امكان
فصل عملية التخمر عن الخلايا الحية نظراً لكونها مجموعة تفاعلات حياتية.
اما كلمة الانزيم فقد اقترحت من قبل الباحث "كون" عام 1878 وبدأت
دراسة خصوصية الانزيمات في نهاية القرن الماضي اذ اشترك إي فيشر E.Fischer عام 1894 في بحث فكرة نوعية الانزيم والعلاقة
الفراغية بين الانزيم والمادة الاساس.
وبدأت دراسات عزل الانزيمات وتنقيتها عام 1920 . وبدأ العالم ولستاتر عام
1922 بعزل بعضها وقام كل من كداما وديكسن عام 1926 باستخلاص الانزيم الذي يؤكسد
الزانشين. واستمر عمل الباحثين يتواصل في تطوير علم الانزيمات
وفروعه المختلفة حتى يومنا هذا. ويمكن ان نحدد على ضوء ماتقدم مفهوم
الانزيمات بانها افرازات بروتينية تنتج من قبل خلايا الجسم المختلفة وفق حاجة تلك
الخلايا, وهي تختلف عن المحفزات غير العضوية بصفات محددة تتضمن الطبيعة الكيميائية
وطريقة العمل وحركيات التفاعلات وحاجتها الى مواد خاصة يطلق عليها بتميمات
الانزيمات.
من الصفات المهمة للخلية قدرتها على القيام بالتفاعلات المعقدة في درجة
حرارة محيطها, وبدون هذه الخلية فان التفاعلات تحصل ببطء. وفي الخلية متسع للآلاف
من الانزيمات, وكل انزيم صمم خصيصاً لاداء مهمة معينة طبقاً لقاعدة محددة
داخل الخلية وعلى ضوء ذلك يمكن ان نتصور وجود هذا العدد الهائل من الانزيمات
المتخصصة في الكائن الحي والتي توفر الطريقة للتحكم في كيمياء الخلية
باقصى دقة ممكنة.
وقد عرف ازولد Oswold
العامل المساعد بانه المؤثر على سرعة التفاعلات والذي يتميز بالخصائص التالية:
يحافظ على تركيب الانزيم الكيميائي اثناء التفاعل, وقد تحدث فيه بعض
التغيرات الطبيعية في بعض التفاعلات الخاصة.
يسرع هذا العامل في الوصول الى حالة التوازن دون التأثير على ثابتة Equilibrium
Constant
ا و موقعة ب يؤثر على سرعة التفاعل لكل من الاتجاهين بدرجة متساوية, وتبقى تراكيز
المواد المختلفة في التوازن الكيميائي ثابتة.
يساهم في الحصول على ابطأ طاقة منشطة Activation
Energy
.
يتميز هذا العامل بخصوصية تفاعلة Reaction Specificity حيث يتوفر عادة حافز واحد لكل تفاعل ولتفاعلات متقاربة.
يُعرَّف الإنزيم بأنه جزيء ضخم يحفز التفاعل الكيميائي الحيوي. تسمى الجزيئات المتفاعلة بالمادة الاساس substrates . يتفاعل الإنزيم مع المادة
الاساس ، ويحولها إلى منتج جديد. تتم تسمية معظم الإنزيمات من خلال الجمع بين اسم المادة
الاساس واللاحقة –ase
(على سبيل المثال ، urease, protease).
تعتمد جميع التفاعلات الأيضية تقريبًا داخل الجسم على الإنزيمات من أجل جعل التفاعلات
تتقدم بسرعة كافية لتكون مفيدة.
يمكن للمواد الكيميائية التي تسمى المنشطات أن تعزز نشاط
الإنزيم ، بينما تقلل المثبطات من نشاط الإنزيم. تسمى دراسة الإنزيمات علم الإنزيمات
enzymology.
هناك فئات عامة تستخدم لتصنيف الإنزيمات:
- انزيمات الاكسدة والاختزال Oxidoreductases : تشارك في نقل الالكترون.
- الانزيمات المميئة Hydrolases : انشقاق المادة الاساس عن طريق التحلل المائي
(امتصاص جزيء الماء)
- الانزيمات المتناظرة Isomerases : وتشمل الانزيمات التي تغير احد تشابهات
مركب الى التشابه الثاني مثل تغير التشابه الضوئي او التشابه الهندسي.
- الانزيمات المكونه Ligases or
synthetases: الانزيمات التي تعمل في تكوين ارتباط اساسي
في تلوين هيكل المركبات العضوية او تكوين حلقي. يقترن انهيار رابطة
البيروفوسفات في النيوكليوتيد بتكوين روابط كيميائية جديدة.
- الانزيمات الناقلة Transferases : نقل مجموعة كيميائية من جزيء إلى آخر.
وتشمل جميع الانزيمات التي تعمل في تفاعلات نقل مجموعات من مركب الى آخر.
كيف تعمل الانزيمات
تعمل الإنزيمات
عن طريق خفض طاقة التنشيط اللازمة لإحداث تفاعل كيميائي. مثل المحفزات catalysts الأخرى ، تغير الإنزيمات توازن
التفاعل ، لكنها لا تستهلك في هذه العملية. في حين أن معظم المحفزات يمكن أن تعمل على
عدد من أنواع التفاعلات المختلفة ، فإن السمة الرئيسية للإنزيم هي أنها محددة. بعبارة
أخرى ، فإن الإنزيم الذي يحفز تفاعلًا واحدًا لن يكون له أي تأثير على تفاعل مختلف.
معظم الإنزيمات
عبارة عن بروتينات كروية أكبر بكثير من المادة الاساس substrate التي تتفاعل معها. وتتراوح
أحجامها من 62 حمضًا أمينيًا إلى أكثر من 2500 من بقايا الأحماض الأمينية ، ولكن جزءًا فقط
من هيكلها يشارك في التحفيز. يحتوي الإنزيم على ما يسمى بالموقع النشط active site ، والذي يحتوي على واحد أو
أكثر من مواقع الارتباط التي توجه المادة الاساس substrate في التكوين الصحيح ، وكذلك موقع تحفيزي
، وهو جزء من الجزيء الذي يقلل من طاقة التنشيط. يعمل ما تبقى من
بنية الإنزيم بشكل أساسي على تقديم الموقع النشط إلى المادة الاساس بأفضل طريقة. قد يكون هناك أيضًا
موقع خيفي allosteric site وهو المكان على الإنزيم الذي قد يرتبط فيه جزيء ليس مادة اساس ، وبالتالي
يغير شكل الإنزيم ويؤثر على قدرته على أن يكون نشطًا.
تتطلب بعض الإنزيمات
مادة كيميائية إضافية تسمى العامل المساعد cofactor لحدوث التحفيز. يمكن أن يكون العامل المساعد عبارة عن أيون معدني أو جزيء
عضوي ، مثل فيتامين. قد ترتبط العوامل المساعدة بشكل فضفاض أو محكم بالإنزيمات. تسمى
العوامل المساعدة المقيدة بإحكام بالمجموعات الاصطناعية prosthetic groups.
هناك تفسيران لكيفية
تفاعل الإنزيمات مع المادة الاساس substrates وهما نموذج
"القفل والمفتاح"
، ونموذج التوافق المستحث
نظرية القفل
والمفتاح
بسبب خصوصية
الانزيم, فانه يتحد مع مادة معينة, حيث يؤثر المفتاح على قفل واحد فقط . وليس كل
المجموعات الموجودة بجزيء الانزيم تدخل في التفاعل المحفز بل إن ما يدخل منها هي
المراكز النشطة.
في التفاعل
المحفز بالإنزيمات تحرر المواد المتفاعلة طاقة تساوي او تزيد على طاقة التنشيط
اللازمة للتفاعل, وإن الإنزيمات تعمل على خفض طاقة التنشيط هذه, فمثلاً عند تحلل
فوق اوكسيد الهيدروجين بدون عامل مساعد , تكون طاقة التنشيط مساوية لــ 18000 ,
وتخفض هذه عند وجود البلاتين كعامل مساعد الى 12000 , بينما في حالة وجود الانزيم Catalase تصبح
هذه الطاقة 2000 سعرة في الوزن الجزيئي الغرامي.
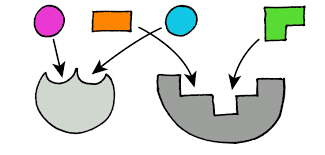
تعتمد هذه النظرية على التكامل الشكلي بين
الانزيم والمادة الاساس التي اعتمدها اميل فشر. ويوضح الشكل التلاحم بين الانزيم
والمادة الاساس وفقا لنموذج المفتاح والقفل لفشر, حيث ان للمادة الاساس مناطق
قطبية وغير قطبية تنجذب فيها المناطق اللاقطبية وتتحد مع المركز النشط الذي يكون
متمماً لها في كل من الشكل والشحنه . وتتكون المناطق اللاقطبية وكذلك ذات الشحنة
الموجبة والسالبة من السلاسل
الجانبية
للمكونات الملامسة, والتي تضع المادة الاساس بوضعية تجعلها تقوى على الالتحام مع
الموقع التحفيزي. بعد حصول عملية التحفيز, تتحرر المنتوجات من المركز النشط,
وبالتالي تحرر الانزيم للقيام بجولة اخرى للتحفيز.
في بعض
الانزيمات تتشابه مواقع الارتباط مع المواد الاساس بما يشبه تقبل القفل لمفتاح
واحد او عدد قليل من المفاتيح, فعند استقرار المادة الاساس على هذه المواقع, تقوم
قوى التجاذب بعملية سحبها الى اسفل لتسبب في وضع اجهاد على اواصر المادة الاساس,
ويؤدي هذا الاجهاد الى اعادة ترتيب الاواصر الكيميائية.
فرضية
كوشلاند )التوافق المستحث(Induced fit
لا تفسر فرضية
القفل والمفتاح بشكل كامل الفعل الانزيمي. على سبيل المثال ، لا يمكن تفسير بعض خصائص
الإنزيمات من خلال العلاقة البسيطة بين الإنزيم والمادة الاساس التي اقترحتها فرضية
مفتاح القفل.
يقترح نموذج الملاءمة
المستحث أن جزيئات الإنزيم يمكن أن تغير شكلها ، اعتمادًا على التفاعل مع المادة
الاساس . في هذا النموذج ، يتغير شكل الإنزيم وأحيانًا المادة الاساس أثناء تفاعلهما
حتى يتم ربط الموقع النشط تمامًا.
تنص النظرية على
أن ارتباط المادة الاساس بالإنزيم يجب أن يتسبب في تغيير شكل الإنزيم الذي ينتج عنه
المحاذاة الصحيحة للمجموعات المحفزة على سطحه. ان التغير في الشكل يضع المكونات
التحفيزية في موقع لكي يغير الاواصر في المادة الاساس . يتبع ذلك تحرير نواتج التفاعل
ويرجع المركز النشط بعد ذلك الى حالته الاولية. تحدث تطبيقات هذه الفرضية عندما
تكون الانزيمات غير متشابهه في مواقع ارتباطها مع المواد الاساس, حيث تجذب المواد
الاساس الاشكال المتشابهه وليس بالضرورة ذات الاشكال المتطابقة , ويكون الجذب عن
طريق اواصر ضعيفة. تم تشبيه هذا المفهوم بملاءمة اليد في القفاز ، فاليد (المادة
الاساس ) تُحدث تغييرًا في شكل القفاز (الإنزيم). على الرغم من أن بعض الإنزيمات تبدو
وكأنها تعمل وفقًا لفرضية القفل و المفتاح الأقدم ، إلا أن معظمها يعمل على ما يبدو
وفقًا لنظرية التوافق المستحث.
هل كل الإنزيمات
بروتينات؟
جميع الإنزيمات
المعروفة تقريبًا عبارة عن بروتينات. في وقت من الأوقات ، كان يُعتقد أن جميع الإنزيمات
عبارة عن بروتينات ، ولكن تم اكتشاف بعض الأحماض النووية ، التي تسمى RNAs أو الريبوزيمات الحفازة ribozymes, والتي لها خصائص تحفيزية. في معظم الأوقات يدرس
الطلاب الإنزيمات ، فهم يدرسون بالفعل الإنزيمات القائمة على البروتين ، حيث لا يُعرف
سوى القليل جدًا عن كيفية عمل الحمض النووي الريبي RNA كمحفز.
تثبيط الانزيم
تسمى المادة
التي تستطيع خفض سرعة التفاعل الانزيمي بالمثبط (Inhibitor) ويعتبر التثبيط بحد ذاته من الاجهزه
المنظمة في الخلايا الحية, ومن الطرق المهمة للتشخيص, وتوفر لها دراسات التثبيط
معلومات عن خصوصية الانزيم والبناء الكيميائي والفيزيائي لمركزه النشط, وكذلك
الآلية الحركية للتفاعل, ومن الامثلة العملية لاستعمالات التثبيط هي طريقة عمل
الادوية واستعمالات المضادات الحية, والحافظات (Preservative), السموم, والتوكسينات.
التثبيط
التنافسي Competitive inhibition
المثبط
التنافسي هو المادة التي تستطيع الاتحاد مع الانزيم الحر لمنع ارتباط المادة
الاساسية, اي تنافس كل من المادة الاساسيو او احد المواد الموجوده في الخلية او في
مادة اساسية اخرى, او حاصل التفاعل . فحامض الملونك Malonic acid هو احد المثبطات التنافسية التقليدية التي
تثبط الانزيم Succinic dehydrogensse
الذي يحفز اكسدة حامض الــ Succinic
الى حامض الــ Fumaric
.
من الامثلة
التقليدية على التثبيط التنافسي هي الادوية السلفونية Sulfo Drug . حيث تؤدي عقاقير السلفا عملها بواسطة
التداخل مع البناء الحياتي لحامض الفولك, حيث يظهر ان الانسان يحصل على حاجته من
حامض الفولك الذي يعتبر هو الآخر فيتاميناً مهماً.
يتضح ان
الادوية السلفونية شكلاً يشبه جزءاً من المركب حامض الفولك المتمثل بــ Para-aminobenzoic acid مما يؤدي الى استعمال جزيئة السلفاناميد لبناء
حامض الفولك, وبالتالي تتوقف عندئذ عملية حياتية مهمة في الجرثومة , وبالتالي
تموت.
التثبيط غير
التنافسي Non-competitive inhibition
ليس للمثبط
غير التنافسي التقليدي اي تأثير على ارتباط المادة الاساسية بالانزيم وبالعكس,
ترتبط كل من I , S بصورة عكسية
عشوائية ومستقللة في مواقع مختلفة , فترتبط I مع E
وكذلك مع ES , وترتبط S بــ E وبــ EI , وبصورة عامة يتميز المركب المعقد المتكون
بكونه غير نشط التحفيز.
ترقيم
الانزيمات
لكل انزيم رقم
يتكون من 4 عناصر, مفصولة عن بعضها بنقاط ومنظمة بالقواعد التالية:
الرقم الاول
يمثل المجموعة التي ينتمي اليها الانزيم 1,2,3,4,5
الرقم الثاني
يمثل الصنف الاضافي لهذه المجموعة (Ssub-class)
لمجموعة
الانزيمات المؤكسدة والمختزلة مثلاً يعبر هذا الرقم عن طبيعة المجموعة الواهية donar group والتي تحصل فيها الاكسدة:
-
يمثل مجموعة CHOH
- يمثل مجموعة الالديهايد او الكيتون.
اما الانزيمات
التابعة للمجموعة الناقلة, فالرقم الثاني يمثل طبيعة المجموعة الناقلة. اما الرقم
نفسه للانزيمات المميئة Hydrolases
فيمثل نوع الاصرة التي تتميأ وكذلك نوع الاصرة التي تتكسر بين المجموعة التاركة
وتلك الباقية للانزيمات الفاصلة بدون تميؤ. ويوضح الرقم الثاني نوع التناظر Isomerases للانزيمات المتناظرة Isomerases .
وكذلك نوع الاصره للانزيمات المكونه Ligases
.
الرقم الثالث
يمثل الصنف الاضافي المضاف sub-class
حيث ان المجموعة المستلمة I,accepter
. تمثل الانزيم المساعد NAD ويختلف الرقم في السايتوكروم (3cytochrome) والاوكسجين
الجزيئي...الخ, للانزيمات المؤكسدة والمختزلة.
اما الرقم
الثالث في المجموعة الناقلة فيمثل نوع المجموعة المستلمة, فقد تكون مجموعة الكاربون
(كالمثيل والكربوكسيل..الخ). وللمجموعة المميئة Hydrolases يوضح بصورة دقيقة نوع الاصرة المميئة وطبيعة
المجموعة المزالة Lyase . اما
الانزيمات المتناظرة , فالرقم الثالث يعبر عن طبيعة التحولات التي تحصل, اما
الانزيمات المكونة لهذا الرقم فتوضح طبيعة المواد المكونة.
مستويات بناء
الانزيمات
نتيجة البحوث
المتتالية وضحت اهمية الاوضاع التي تاخذها السلاسل الببتيدية في شكل مبرم حلزوني
او التفاف على بعضها, او مع بعضها وغيرها من الاوضاع التي لها اثر كبير في سلوك
الانزيمات وخواصها.
الاواصر التي تثبت
جزيئة الانزيم في اوضاعها:
الاواصر
الايونيو Ionic Bonds
الاواصر
الهيدروجينية Hydrogen bonds
الاواصر
ثنائية الكبريتيد Disulfide linbage
تجاذب
فاندرفال Van Der Vall Forces
التصادم
القطبي للمجاميع Polar Group Interaction
البناء الاول Primary structure
ويحدد نوع
الاحماض الامينية وتتابع ترتيبها في السلسلة الببتيدية, وهذا البناء يمثل هيكل Backbone للسلسلة الببتيدية وما يتصل بها من ذرات
ومجموعات.
البناء الثاني
Secondary structure
ويتمثل
بالتركيب التكويني Conformation للسلسلة الببتيدية والتي تشمل الالتفاف مع طول
السلسلة او التفاف السلاسل الببتيدية مع بعضها في شكل حلزوني والتصاقها مع بعضها,
وهذا يحدد التوزيع الفضائي للذرات والمجموعات في السلسلة الببتيدية. ويثبت هذا
البناء بالاواصر الثانوية التي من اهمها الاصرة الهيدروجينية ويتضمن هذا البناء
السلاسل الببتيدية باشكال مختلفة وهي:
نموذج الفا :
ويتضمن سلسلتين ببتيديتين او اكثر تلتف على طول بعضها التفافاً حلزونياُ فتكون
شكلاً حلزونياً Helics وان طول
اللفة او البرمة الواحدة في الحلزون 3.6 وحدة حامض اميني.
نموذج بيتا:
ويعبر عنه التركيب البسيط غير المكثف, وفيه ترتبط سلسلتان ببتيديتان مبرومتان او
اكثر على طولها دون التفاف على بعضها او تكوين حلزوني .
البناء الثالث
Tertiary structure
ويشمل الشكل
العام المجسم ثلاثي الابعاد للانزيم, ويحدد التفاف السلاسل الببتيدية على بعضها,
وهذا التركيب تثبته الروابط الثانوية كالاصرة ثنائية الكبريتيد والتي لها اهمية في
تثبيت هذا البناء, ويمكن معرفة هذا البناء باستعمال اشعة اكس.
البناء الرابع
Quaternary structure
وهو البناء
الناتج من تجمع بعض جزيئات الانزيم مع بعضها, ويتوقف هذا البناء على نوع البروتين
ونوع الشحنات الكهربائية ودرجة حموضة المحلول, وتعمل الرابطة ثنائية الكبريتيد على
تثبيت هذا البناء.
المصـــــــــــــــــادر:
سامي المظفر,-اساسيات الكيمياء الحياتية.-
دار المسيرة,-2009 .
Protein - Inhibition of enzymes | Britannica
Enzyme Biochemistry - What They Are and How They
Work
https://www.thoughtco.com/enzyme-biochemistry-4042435
Accessed: 2020-09-25.


تعليقات
إرسال تعليق